Mammographische Mikrokalkanalyse und Histologie des Mammakarzinoms
Während
der Pathologe die karzinomatöse Umwandlung der Zellen
und Zellverbände direkt beobachten kann und der Nachweis von Mikroverkalkungen
für ihn nur einen unbedeutenden Nebenbefund darstellt, sind die Verkalkungen
für den Mammographeur eine wichtige diagnostische
Leitstruktur. 1951 wurde von Leborgne [Leborgne 1951] zum ersten Mal über den radiologischen
Nachweis von kleinsten Verkalkungen in Zusammenhang mit Karzinomen der Mamma berichtet. Seitdem konzentriert sich das Interesse
des Untersuchers auf Mikrokalkansammlungen als mammographische
Leitstrukturen zur Detektion intraduktaler
Karzinome, die sich oft im präinvasiven Stadium als duktales Carcinoma in situ (DCIS) befinden. In diesen Fällen
können die nur mammographisch erfaßbaren Verkalkungen
ohne Weichteilverdichtungen der einzige frühe Hinweis auf einen bösartigen Prozeß sein.
Um
eine mammographische Karzinomdiagnostik aufgrund der
Analyse der Mikrokalkmorphologie zu ermöglichen, wurden morphologische
Kriterien für die Mikrokalkanalyse durch Korrelationen mit dem histopathologischen Befund erarbeitet. Die bisherigen von
der Subjektivität des Untersuchers geprägten Analysen mit unterschiedlicher
Terminologie machten einen Vergleich der Untersuchungsergebnisse unmöglich.
Zur Illustration dieses methodischen Problems soll die Zusammenfassung der
beschreibenden Adjektive für mit einem Karzinom einhergehende Mikroverkalkungen
anhand eines Literaturüberblicks von Lanyi unter
Berücksichtigung von 25 Publikationen (1951 bis 1984) dienen [Lanyi 1986]:
amorph, bizarr, eckig, elongiert,
fein, feinkörnig, feinschollig, flau, glatt, grob,
halbmondförmig, irregulär, kaulquappenförmig, kometförmig,
kristallin, linienförmig, nadelförmig, Polymorphie,
rundlich, salzkornartig, sandkörnchenartig, spikulaförmig,
spitzenartig, stabförmig, Stippchen, uneinheitlich, unregelmäßig, verästelt,
wellig, wurmförmig.
Zur
Vereinheitlichung der Terminologie bei der Befundmitteilung und Abschätzung des
mammographischen Verdachts auf Malignität wurde von
dem American College of Radiology ein Katalog von
definierten mammographischen Befunden vorgestellt (Breast Imaging Recording and Data System,
BI-RADS) [American College of Radiology 1995], der
auch internationale Bedeutung erlangt hat. Hinsichtlich der Einordnung und
Differenzierung gutartiger von bösartigen Mikroverkalkungen bleibt dieser
Katalog jedoch hinter der im deutschen Sprachgebrauch üblichen Terminologie
zurück, die im Wesentlichen auf den Arbeiten von Lanyi
beruht. Dieser erarbeitete in enger Anlehnung an die Histologie umfangreiche
morphologische Kriterien zur mammographischen Dignitätsbeurteilung der Mikroverkalkungen.
Anatomisch
besteht die Mamma aus dem Drüsenkörper, der sich aus
15 bis 20 nebeneinanderliegenden Drüsenlappen (Lobi, Segmente) zusammensetzt. Jeder Drüsenlappen besitzt
einen Hauptmilchgang, der auf der Mamille endet oder retromamillär über Milchsäckchen (Sinus lactiferi)
mit anderen Milchgängen kommunizieren kann. Die Drüsenlappen (Lobi) teilen sich weiter in bis 2mm große Drüsenläppchen (Lobuli) auf, in denen sich die terminalen
Milchgänge und die Drüsenendstücke (Azini, Alveoli) befinden. Ausgekleidet mit Zylinderepithel
werden sie von Myoepithelzellen (Korbzellen) und der Basalmembran umgeben. Diese terminale
duktulobuläre Einheit ist das histopathologische
Korrelat, in dem die Mehrzahl der benignen und
malignen Brustdrüsenerkrankungen entstehen.
Adenosen
sind gutartige proliferative Veränderungen der Lobuli mit Hyperplasie der Epithel- und Myoepithelzellen.
Sie werden meist dem Oberbegriff "Mastopathie"
subsummiert und sind klinisch prämenstruell
gelegentlich mit leichten Schmerzen (Mastodynie)
verbunden. Im Rahmen hormonabhängiger proliferativer
Vorgänge kann es zu Erweiterungen (mikrozystische Mastopathie, blunt duct adenosis) oder Einengung der
Lumina der Azini (sklerosierende Adenose) in den Lobuli kommen (Abbildung
1). Lobulären Mikrokalk in Verbindung mit gutartigen Adenosen erkennt man aufgrund der Läppchenarchitektur
mammographisch als rundliche Kalkgruppen mit typischen Semmel- und Morulaanordnungen sowie Facettierungen der eng aneinanderliegenden Einzelverkalkungen, die lediglich durch
die Azinuswände voneinander getrennt sind. Je nach Proliferationsform der Adenose
stellt sich der Mikrokalk entsprechend der Größe der Azini
entweder
·
als Kalkmilch
mit Sedimentationseffekt in der mediolateralen
Projektion (Teetassenphänomen bei mikrozystischer Mastopathie),
·
als rundliche,
facettierte (blunt duct adenosis) oder
·
als punktförmige
Einzelverkalkungen (sklerosierende Adenose) dar [Lanyi 1997].
Bei allen diesen Verkalkungsformen handelt es
sich um appositionell wachsende schalenförmige
rundliche Psammonverkalkungen im Sekret sekretorisch aktiver Drüsenanteile.
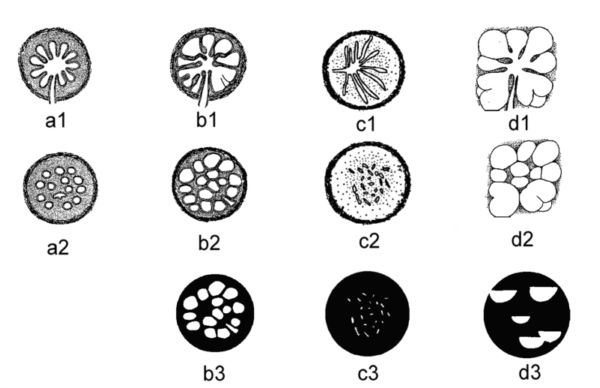
Abbildung
1:
Adenosen und Mikrokalk: Schematische Darstellung
modifiziert nach Lanyi [Lanyi
1986]. Normaler Lobulus im Längs- (a1) und
Querschnitt (a2). Blunt-duct-Adenose (b) mit
rundlichen, teilweise facettierten Mikroverkalkungen (b3). Die Facettierungen
entstehen durch die Septen zwischen den Lichtungen
der Azini. Die Architektur des Lobulus
erklärt die runde Gruppenform teilweise mit Semmel- und Morulaanordnungen.
Sklerosierende Adenose (c)
mit feinen Mikroverkalkungen (c3), die differentialdiagnostische Probleme in
der Abgrenzung zum Karzinom aufwerfen können. Kleinzystische
Adenose (d) mit Sedimentation der Mikroverkalkungen
und Entstehung des Teetassenphänomens in der lateralen Projektion (d3).
Den
ebenfalls mit Verkalkungen einhergehenden duktalen
Typ des Mammakarzinoms kennzeichnet eine intraluminale epitheliale Proliferation in den terminalen
und interlobulären Milchgängen [Sloane
et al. 1997]. Im präinvasiven Frühstadium, das für
die Brustkrebsfrüherkennung besonders wichtig ist, kommt es zu einer intraduktalen Ausbreitung der Tumorzellen als duktales Carcinoma in situ (DCIS). Wachstumsmuster,
Zelltypisierung, Kernmalignitätsgrad,
immunhistologische Marker und Differenzierung sind zur Bestimmung des Malignitätsgrads in Form verschiedener histopathologischer
Klassifikationen herangezogen worden [Böcker et al.
1997].
Für
die mammographische Diagnostik hat sich die
Differenzierung nach dem Vorhandensein von Komedonekrosen
in ein Komedo- versus Non-Komedo-DCIS
bewährt. Der Komedo-Typ zeigt ausgedehnte Nekrosen in den erweiterten
Milchgängen. Diese Nekrosen verkalken und imponieren mammographisch aufgrund
ihrer typischen intraduktalen Ausbreitung wie ein Ausguß der Milchgänge. Der DCIS vom Komedo-Typ bietet
mammographisch wegen der typischen Morphologie der granulären
Mikroverkalkungen mit Polymorphie und x,y,z-Formen meist keine größeren
diagnostischen Schwierigkeiten. Die Erkennung gerade dieser Form des DCIS ist
wichtig, da aufgrund der niedrigen Differenzierung ein exspektatives
Vorgehen kontraindiziert ist [Holland und Hendriks
1994; Kreipe et al. 1994].
Im
Gegensatz dazu ist das Non-Komedo-DCIS mit einer
höheren Differenzierung und einem niedrigeren Malignitätsgrad
korreliert. Es weist keine Nekrosen auf und zeigt ein überwiegend kribriformes mikropapilläres
Wachstumsmuster mit siebartigen, schweizerkäseartigen porösen Strukturen in den
mit Tumorzellen ausgefüllten Drüsenlumina (kribriform) oder stummelartig nach luminal
gerichteten Epithelknospen (mikropapillär) (Abbildung 2). Die Formen der
Einzelverkalkungen sind mammographisch oft nicht von gutartigen azinären Mikroverkalkungen (z.B. sklerosierende
Adenose) zu unterscheiden. Ebenso wie bei dem azinären Verkalkungstyp handelt es sich bei diesem
Mikrokalk überwiegend um appositionell wachsende
schalenförmige rundliche Psammonverkalkungen.
In
diesen Fällen kann die Analyse der Form der Mikrokalkgruppe
differentialdiagnostische Hinweise liefern. So bildet sich ein DCIS oder invasives duktales Mammakarzinom
aufgrund des intraduktalen Wachstums mit segmentaler
Anordnung der Mikroverkalkungen mammographisch als dreieckförmige oder trapezoide Mikrokalkgruppe ab (Abbildung 2). Bei konsequenter Anwendung dieses "Prinzip der
dreieckförmigen Mikrokalkgruppe" konnte Lanyi
hinsichtlich der mammographischen Diagnose des duktalen Karzinoms mit Mikroverkalkungen eine Sensitivität
von 97,6 % bei einer Spezifität von 73,3 % erhalten [Lanyi
1982; Lanyi und Neufang 1984].
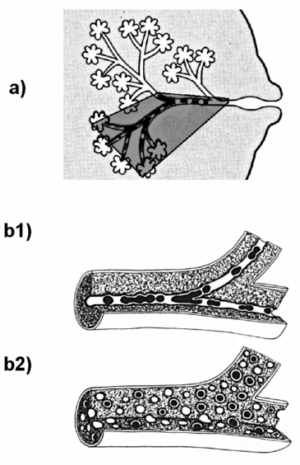
Abbildung
2: Segmentale intraduktale Karzinomausbreitung
aufgrund der Anatomie des Milchgangsystems (a). Intraduktale
Anordnung von verkalkten Nekrosen beim duktalen in-situ Karzinom vom Komedotyp (b1). Mikroverkalkungen beim
duktalen in-situ Karzinom
vom mikropapillär-kribriformen Typ (nach Lanyi [Lanyi 1986]).
Präparateradiographie und interventionelle Mammographie
Ein
mammographisch malignomverdächtiger Befund mit
Mikroverkalkungen in der Brustdrüse muß einer
histologischen Klärung zugeführt werden. In der Regel erfolgt die
Gewebeentnahme durch eine operative Probeexzision.
Nach einer präoperativen palpatorischen,
sonographischen, mammographischen
oder kernspintomographischen Markierung des
verdächtigen Areals mit einer Drahtmarkierung - alternativ auch Farbstoff- oder
Kohlepartikelmarkierung - wird der Herd zusammen mit dem Markierungsdraht
operativ entfernt. Bei verdächtigem Mikrokalk muß zur
Sicherstellung der vollständigen Erfassung des Areals eine Präparateradiographie
erfolgen. Das Ergebnis der Präparateradiographie wird
dem Operateur sofort mitgeteilt, da bei einer fehlenden oder unvollständigen
Erfassung des verdächtigen Areals Nachresektionen durch den Operateur erfolgen
müssen. Gleichzeitig wird das Präparat an den Pathologen zur histologischen
Aufarbeitung weitergeleitet.
Vorteile
des operativen Vorgehens im Vergleich zur Fein- oder Grobnadelbiopsie sind die
Möglichkeit zur sofortigen Erweiterung des operativen Eingriffs mit Dissektion der Axilla und
Gewinnung der Lymphknoten bei histologischem Nachweis eines invasiven
Karzinoms sowie die erhöhte Wahrscheinlichkeit, aufgrund der Entfernung eines
größeren Gewebevolumens, den malignomverdächtigen
Mikrokalkherd komplett zu erfassen. Der Nachteil ist der hohe Anteil von
retrospektiv unnötigen Operationen bei fehlendem histologischen Malignomnachweis aufgrund der geringen Spezifität der
diagnostischen Methoden. Im Rahmen der Deutschen Mammographiestudie lag der
positive Vorhersagewert (PPV, relativer Anteil der bösartigen histologischen
Befunde im Verhältnis zu den Biopsieempfehlungen) kumulativ bei 0,34 [Robra et al. 1994a]. Demnach waren 2/3 der Operationen, die
aufgrund der mammographischen Diagnose "malignomverdächtig" (Mikroverkalkungen, sternförmige
Verdichtungsstrukturen, Architekturstörungen und Gewebeasymmetrien)
durchgeführt wurden, retrospektiv nicht indiziert gewesen. Weitere Nachteile
sind das Narkoserisiko, ein kostspieliger stationärer Aufenthalt von mehreren
Tagen sowie eine sowohl kutane als auch intramammäre postoperative Narbe, die neben kosmetischen
Aspekten eine spätere Früherkennung von Brustkrebs erschwert.
In den letzten Jahren fanden zunehmend minimalinvasive diagnostische Verfahren wie die Fein- oder
Grobnadelbiopsie Verbreitung. Diese Verfahren hinterlassen so gut wie kein
Narbengewebe und die Kosten betragen etwa ein Drittel der Kosten für die
Operation, da sie ohne Narkose ambulant durchgeführt werden können [Burkhardt und Sunshine 1999].
Hierbei wird mit Hilfe eines bildgebenden Verfahrens
der verdächtige Herd lokalisiert.
Für die Lokalisation von Mikroverkalkungen werden
stereotaktische Verfahren eingesetzt. In Abbildung
3 ist das Prinzip der stereotaktischen Lokalisation schematisch gezeigt. Die
Brust wird mit jeweils 10 Grad zur Senkrechten mammographiert.
Man erhält hierdurch zwei Bilder, die sich mit Hilfe der Abbildung eines fest
eingebauten Markers in Beziehung setzen lassen. Je nach Höhe (z-Koordinate) des
zu lokalisierenden Herdes wird dieser bei gleichen x und y-Koordinaten an
verschiedenen Orten abgebildet. Der Höhenabstand des Herdes vom Bildempfängersystem
errechnet sich aus der Hälfte des Abstands der Abbildungen des Herdes auf den
beiden Bildausschnitten (Lateralverschiebung) geteilt durch den Tangens von 10o.
Ein Mikrocomputer errechnet die x -, y - und z - Koordinaten unter Verwendung
des oben beschriebenen Algorithmus und gibt elektronisch die Werte
an die Biopsieeinheit über eine Schnittstelle weiter. Die Biopsie kann dann
vollautomatisch durch motorisiertes
Vorschieben der Biopsienadel auf die berechneten Koordinaten in der Brust
erfolgen.
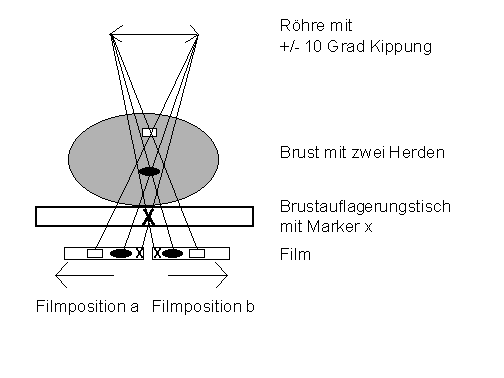
Abbildung 3: Schematische
Darstellung des Prinzips der stereotaktischen Mammabiopsie.
Mehrere Studien haben über hohe Sensitivitäts- und Spezifitätswerte perkutaner Stanzbiopsieverfahren hinsichtlich des Nachweises von Mammakarzinomen berichtet [Jackman et al. 1994; Liberman et al. 1995a; Liberman et al. 1995b; Liberman et al. 1995c; Liberman et al. 1997b; Schulz-Wendtland et al. 1993; Schulz-Wendtland et al. 1997]. Im Vergleich zur sonographisch geführten Nadelbiopsie ist bei der stereotaktisch geführten Stanzbiopsie von Mikrokalzifikationen ohne Weichteilanteil die Sensitivität reduziert [Liberman et al. 1997a]. Dies liegt überwiegend an der geringen Größe der Areale mit teilweise nur vereinzelt vorkommenden Mikrokalzifikationen. Die in das weiche Drüsengewebe eindringenden Nadeln können zu einer Verlagerung der angepeilten Mikroverkalkungen führen. In den letzten Jahren werden minimalinvasive Biopsieeinheiten angeboten, die den Eingriff bei der liegenden Patientin ermöglichen. Spezielle Nadeln mit einem Vakuumansaugsystem sollen gezieltere und umfassendere Entnahmen mit einer Reduktion der Trefferversager ermöglichen [Heywang-Köbrunner et al. 1998; Meyer et al. 1997; Parker und Klaus 1997].
J.-H. Grunert